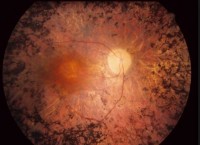
La posibilidad de revertir la ceguera ha dado un salto significativo, según los científicos en el Reino Unido.
Un estudio publicado el 21 de Julio de 2013, en la revista Nature Biotechnology, demuestra que la parte del ojo que realmente detecta la luz puede ser reparada en animales utilizando células madre.
El equipo de Moorfields Eye Hospital y University College London aseguran que ensayos en humanos son ahora, por primera vez, una perspectiva realista.
Expertos lo describien como un "importante avance" y el "gran salto" hacia adelante.
Los fotorreceptores son las células de la retina que reaccionan a la luz y la convierten en una señal eléctrica que puede ser enviada al cerebro.
Sin embargo, estas células pueden extinguirse en algunas causas de ceguera como la enfermedad de Stargardt y degeneración macular relacionada con la edad.
Ya hay ensayos en las personas para utilizar células madre para reemplazar las células "apoyo" en el ojo, que mantienen vivos los fotorreceptores.
Ratones ciegos
Ahora el equipo londinense ha demostrado que es posible reemplazar las células que funcionan como sensores de luz, por ellos mismos, elevando la posibilidad de revertir la ceguera.
Se ha utilizado una nueva técnica para la construcción de las retinas en el laboratorio. Fue utilizado para recoger miles de células madre, que estaban preparadas para transformarse en fotorreceptores y se inyectó en los ojos de ratones ciegos.
El estudio mostró que estas células podrían enganchar con la arquitectura existente del ojo y empezar a funcionar.
Sin embargo, la eficacia es todavía baja. En realidad sólo unos 1.000 células de un trasplante de 200.000 conectada con el resto del ojo.
El Responsable, Prof Robin Ali dijo al sitio web de noticias de BBC: "esto es una verdadera prueba de concepto que fotorreceptores pueden ser transplantados desde una fuente de células madre embrionarias y eso nos da un mapa de ruta para hacerlo ahora en seres humanos.”
Agregó "Es por ello por lo que estamos tan emocionados, cinco años es ahora un objetivo realista para iniciar un ensayo clínico."

Bastones de color azul y conos, de colores azul-verde, detectan la luz y crean señales eléctricas que se envían al cerebro.
El ojo es uno de los campos más avanzados para la investigación de células madre.
Es relativamente simple, como las células de detección ligeras sólo tienen que pasar su mensaje eléctrico a una célula más para llevar sus mensajes al cerebro, a diferencia de un intento de revertir la demencia que requeriría células a enganchar con células mucho más complejas a través de todo el cerebro.
El sistema inmune también es muy débil en el ojo así que hay una oportunidad baja de rechazo del trasplante. Algunas células también pueden hacer una gran diferencia en el ojo. Decenas de miles de células madre en el ojo podrían mejorar la visión, pero ese número de células madre no podría regenerar un órgano mucho más grande como una insuficiencia hepática.
El Prof Chris Mason, del University College de Londres, dijo a la BBC: "Creo que aquí han hecho un gran avance, pero la eficacia es aún demasiado baja para usos clínicos. En este momento el número es minúsculo y llevará un poco de trabajo para obtener números mayores y luego la siguiente pregunta es 'Puede usted hacerlo en el hombre?”
"Pero creo que es un avance significativo que puede conducir a terapias con células madre y le dará un conocimiento mucho más amplio sobre cómo curar la ceguera".
Dr. Marcelo Rivolta, de la Universidad de Sheffield, dijo que el estudio era un "gran salto" hacia adelante para tratar la ceguera y podría tener implicaciones a través de la investigación con células madre.
Fuente original en inglés: http://www.bbc.co.uk/news/health-23374623
Datos del estudio en inglés: http://www.nature.com/nbt/journal/vaop/ncurrent/full/nbt.2643.html
Traducción: Rodrigo Lanzón.